La directora de la EMA alerta de que los europeos deben confirmar la vacuna
Que las vacunas de la Covid-19 tengan una eficacia del 90 % es “muy buena noticia”, pero ese es “el análisis de las empresas
11:15 09/12/20
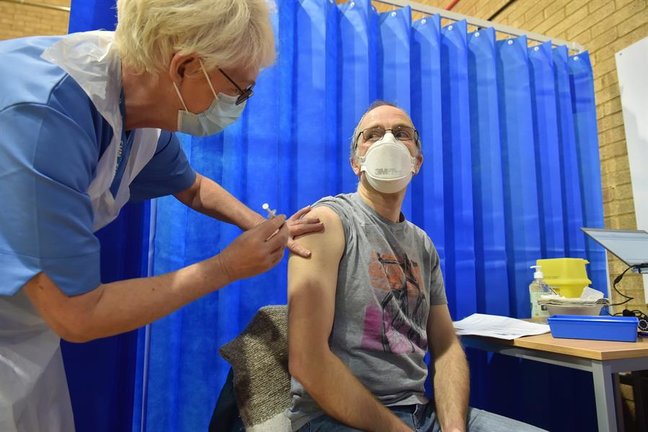
Los europeos están “mejor protegidos con una vacuna autorizada” por la Agencia Europea del Medicamento (EMA), alerta a Efe su directora ejecutiva, Emer Cooke, que subraya que se deben confirmar todos los estudios hechos por las farmacéuticas antes de dar una “autorización consistente que se pueda implementar a principios de año”.
Que las vacunas de la Covid-19 tengan una eficacia del 90 % es “muy buena noticia”, pero ese es “el análisis de las empresas” y las autoridades europeas “deben confirmar” que los estudios hechos hasta ahora son suficientes. “Estamos trabajando muy duro para cumplir con las expectativas de la población europea”, asegura Cooke en una entrevista en Ámsterdam, en la sede de la EMA.
Antes de aterrizar el pasado octubre al frente de esta agencia europea, la irlandesa Cooke era directora del Departamento de Regulación y Precalificación de la Organización Mundial de la Salud (OMS) en Ginebra, y tiene casi tres décadas de experiencia en asuntos de regulación internacional sanitaria que ahora aplica desde la EMA para acercar a la UE cada vez más hacia la vuelta a la normalidad.
Hace una semana, recibió las solicitudes formales de autorización condicional de las farmacéuticas Pfizer/BionNTech y Moderna para el uso de sus vacunas en la UE, después de que el Reino Unido empezara a vacunar a sus ciudadanos este martes sin necesidad de esperar a la revisión de esta agencia tras el Brexit, que entró en vigor el pasado 1 de febrero.
Espera que su equipo termine la revisión de esas solicitudes antes del 29 de diciembre en el caso de Pifzer, y del 12 de enero para Moderna, porque de esta última recibió menos datos clínicos estas semanas y aún están intercambiando la información necesaria.
“Nosotros queremos estar muy seguros de que revisamos los datos con cuidado. Tenemos que decidir las condiciones que la farmacéutica deberá cumplir una vez logre la autorización condicional. Hacer eso bien nos lleva tiempo (…) Tenemos que juntar todo para dar una autorización que sea consistente y que estemos seguros de que se pueda implementar a principios del próximo año”, defiende.
A la espera de los resultados de la EMA, Hungría mostró su interés en la vacuna Sputnik V, desarrollada por Rusia, que no está siendo analizada por la EMA.
“Realmente creemos que los pacientes están mejor protegidos con una vacuna autorizada, pero si hay una situación en la que hay una necesidad pública muy alta y la farmacéutica o el país dice que los beneficios superan los riesgos para su población, entonces son libres de permitir el uso temporal de un producto sin licencia”, considera.
EL TIEMPO Y LA PRESIÓN
La EMA tiene un sistema de revisión por pares para garantizar que el resultado sea lo más válido y fiable posible. “Nombramos a un relator y un correlator para revisar los archivos de forma independiente, hay una red de expertos a lo largo y ancho de la UE analizando datos, tenemos expertos clínicos, en farmacovigilancia, en calidad…”, enumera Cooke.
“Ahora tenemos que confirmar con nuestra revisión que son suficientes todos estos estudios de seguridad que se han realizado y que estamos seguros de que la empresa pueda producir estas vacunas en una forma reproducible y de alta calidad”, añade.
Las vacunas más avanzadas han sido desarrolladas en un tiempo récord y la EMA lanzó a principios de octubre un proceso de revisión en tiempo real de todos los datos que vayan ofreciendo las farmacéuticas para acelerar el proceso de análisis, en lugar de esperar hasta que terminen los ensayos clínicos, por lo que lleva meses de trabajo adelantado.
“Tanto el personal como los expertos y yo nos sentimos bajo presión, sobre todo porque queremos hacer las cosas bien. Es una responsabilidad muy grande aprobar un fármaco para una vacunación masiva, en especial cuando se ha desarrollado en tan poco tiempo. El paquete de datos que tenemos es mucho más grande de lo que normalmente recibimos para una vacuna”, reconoce.
TEORÍAS DE LA CONSPIRACIÓN
Aunque ahora mismo tengan entre sus manos “un paquete de datos enorme a revisar” y se necesita “mucho trabajo” para analizarlo todo, la buena noticia, dice, es que “hay mucha información (sobre las vacunas) y eso debe ser tranquilizador” para la sociedad.
Cooke asegura que la EMA “se toma muy en serio todo lo relativo a la comunicación en torno a los beneficios y riesgos de las vacunas, especialmente en un mundo donde hay tanta información falsa en todas partes” tratando de crear desconfianza hacia el trabajo científico.
Considera que abordar este problema es también responsabilidad de la EMA, que trabajará para asegurarse de que es “la fuente de información definitiva y fiable sobre las vacunas”, y para ayudar a crear confianza en la población, implementará una estrategia de comunicación contra los “teóricos de la conspiración y los antivacunas”.
Que las vacunas de la Covid-19 tengan una eficacia del 90 % es “muy buena noticia”, pero ese es “el análisis de las empresas” y las autoridades europeas “deben confirmar” que los estudios hechos hasta ahora son suficientes. “Estamos trabajando muy duro para cumplir con las expectativas de la población europea”, asegura Cooke en una entrevista en Ámsterdam, en la sede de la EMA.
Antes de aterrizar el pasado octubre al frente de esta agencia europea, la irlandesa Cooke era directora del Departamento de Regulación y Precalificación de la Organización Mundial de la Salud (OMS) en Ginebra, y tiene casi tres décadas de experiencia en asuntos de regulación internacional sanitaria que ahora aplica desde la EMA para acercar a la UE cada vez más hacia la vuelta a la normalidad.
Hace una semana, recibió las solicitudes formales de autorización condicional de las farmacéuticas Pfizer/BionNTech y Moderna para el uso de sus vacunas en la UE, después de que el Reino Unido empezara a vacunar a sus ciudadanos este martes sin necesidad de esperar a la revisión de esta agencia tras el Brexit, que entró en vigor el pasado 1 de febrero.
Espera que su equipo termine la revisión de esas solicitudes antes del 29 de diciembre en el caso de Pifzer, y del 12 de enero para Moderna, porque de esta última recibió menos datos clínicos estas semanas y aún están intercambiando la información necesaria.
“Nosotros queremos estar muy seguros de que revisamos los datos con cuidado. Tenemos que decidir las condiciones que la farmacéutica deberá cumplir una vez logre la autorización condicional. Hacer eso bien nos lleva tiempo (…) Tenemos que juntar todo para dar una autorización que sea consistente y que estemos seguros de que se pueda implementar a principios del próximo año”, defiende.
A la espera de los resultados de la EMA, Hungría mostró su interés en la vacuna Sputnik V, desarrollada por Rusia, que no está siendo analizada por la EMA.
“Realmente creemos que los pacientes están mejor protegidos con una vacuna autorizada, pero si hay una situación en la que hay una necesidad pública muy alta y la farmacéutica o el país dice que los beneficios superan los riesgos para su población, entonces son libres de permitir el uso temporal de un producto sin licencia”, considera.
EL TIEMPO Y LA PRESIÓN
La EMA tiene un sistema de revisión por pares para garantizar que el resultado sea lo más válido y fiable posible. “Nombramos a un relator y un correlator para revisar los archivos de forma independiente, hay una red de expertos a lo largo y ancho de la UE analizando datos, tenemos expertos clínicos, en farmacovigilancia, en calidad…”, enumera Cooke.
“Ahora tenemos que confirmar con nuestra revisión que son suficientes todos estos estudios de seguridad que se han realizado y que estamos seguros de que la empresa pueda producir estas vacunas en una forma reproducible y de alta calidad”, añade.
Las vacunas más avanzadas han sido desarrolladas en un tiempo récord y la EMA lanzó a principios de octubre un proceso de revisión en tiempo real de todos los datos que vayan ofreciendo las farmacéuticas para acelerar el proceso de análisis, en lugar de esperar hasta que terminen los ensayos clínicos, por lo que lleva meses de trabajo adelantado.
“Tanto el personal como los expertos y yo nos sentimos bajo presión, sobre todo porque queremos hacer las cosas bien. Es una responsabilidad muy grande aprobar un fármaco para una vacunación masiva, en especial cuando se ha desarrollado en tan poco tiempo. El paquete de datos que tenemos es mucho más grande de lo que normalmente recibimos para una vacuna”, reconoce.
TEORÍAS DE LA CONSPIRACIÓN
Aunque ahora mismo tengan entre sus manos “un paquete de datos enorme a revisar” y se necesita “mucho trabajo” para analizarlo todo, la buena noticia, dice, es que “hay mucha información (sobre las vacunas) y eso debe ser tranquilizador” para la sociedad.
Cooke asegura que la EMA “se toma muy en serio todo lo relativo a la comunicación en torno a los beneficios y riesgos de las vacunas, especialmente en un mundo donde hay tanta información falsa en todas partes” tratando de crear desconfianza hacia el trabajo científico.
Considera que abordar este problema es también responsabilidad de la EMA, que trabajará para asegurarse de que es “la fuente de información definitiva y fiable sobre las vacunas”, y para ayudar a crear confianza en la población, implementará una estrategia de comunicación contra los “teóricos de la conspiración y los antivacunas”.











